2022-08-11 17:00
近日,易文赛研究院在《Human Cell》杂志发表题为《Establishment and characterization of IPS-OGC-C1: a novel induced pluripotent stem cell line from healthy human ovarian granulosa cells》的研究论文。本研究建立了来自人卵巢颗粒细胞的一种新型诱导多能干细胞系(IPS-OGC-C1),为泌尿生殖系统发育和致病机制相关研究提供了模型。该研究是易文赛生物药物研发团队与浙江大学医学院团队关于IPS转化研究所取得的阶段性成果之一。

诱导多能干细胞(induced pluripotent stem cells, iPSCs),是日本科学家山中伸弥(ShinyaYamanaka)将四个与干细胞特性相关的转录因子Oct3/4、Sox2、c-Myc以及Klf4(简称OSKM,也被称为「山中因子」),通过逆转录病毒载体转入小鼠的成纤维细胞,即可诱导其分化成多能干细胞。
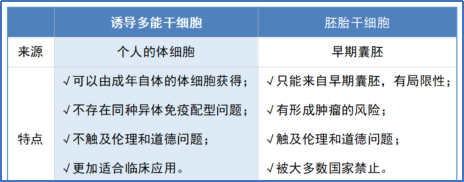
它们在形态、基因和蛋白表达、表观遗传修饰状态、细胞倍增能力、类胚体和畸形瘤生成能力、分化能力等方面都与胚胎干细胞相似,同时又避开了胚胎干细胞涉及的伦理问题和社会争议,在疾病模型、药物筛选和细胞治疗中有着巨大的应用前景,被人们视为细胞疗法的新希望。2012年,山中伸弥也因此在IPS领域的开创性研究获得了当年的诺贝尔生理学或医学奖。
关于iPSC研究的一个挑战是DNA的变化会导致基因的强制表达。就临床应用而言,实现重编程过程的安全有效性非常关键。在本项研究中,随着iPSC重编程进行,可观察到重组细胞(IPS-OGC-C1),碱性磷酸酶染色呈阳性(图2B)。此外核型分析表明IPS-OGC-C1细胞稳定保持着亲代OGC的核型(图2C)。

畸胎瘤是由人体多能干细胞直接注射到免疫缺陷小鼠中直接形成的具有血管组织的复杂结构,一般能够涵盖胚胎的三个胚层,即内胚层、中胚层以及外胚层。能否在畸胎瘤中形成三胚层混合的结构也一度成为鉴定干细胞多能性的黄金标准。
在本研究中,畸胎瘤形成试验证实IPS-OGC-C1的分化能力,细胞可分化为所有三个胚层:内胚层(肠上皮)、中胚层(软骨)和外胚层(视网膜色素上皮)(图D),并表达三个胚膜的标记物(内胚层:AFP;中胚层:α-SMA;外胚层:巢蛋白)(图A)。
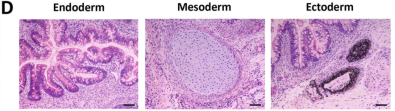
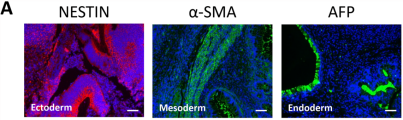
人OGC-iPSC显示出高分化潜能
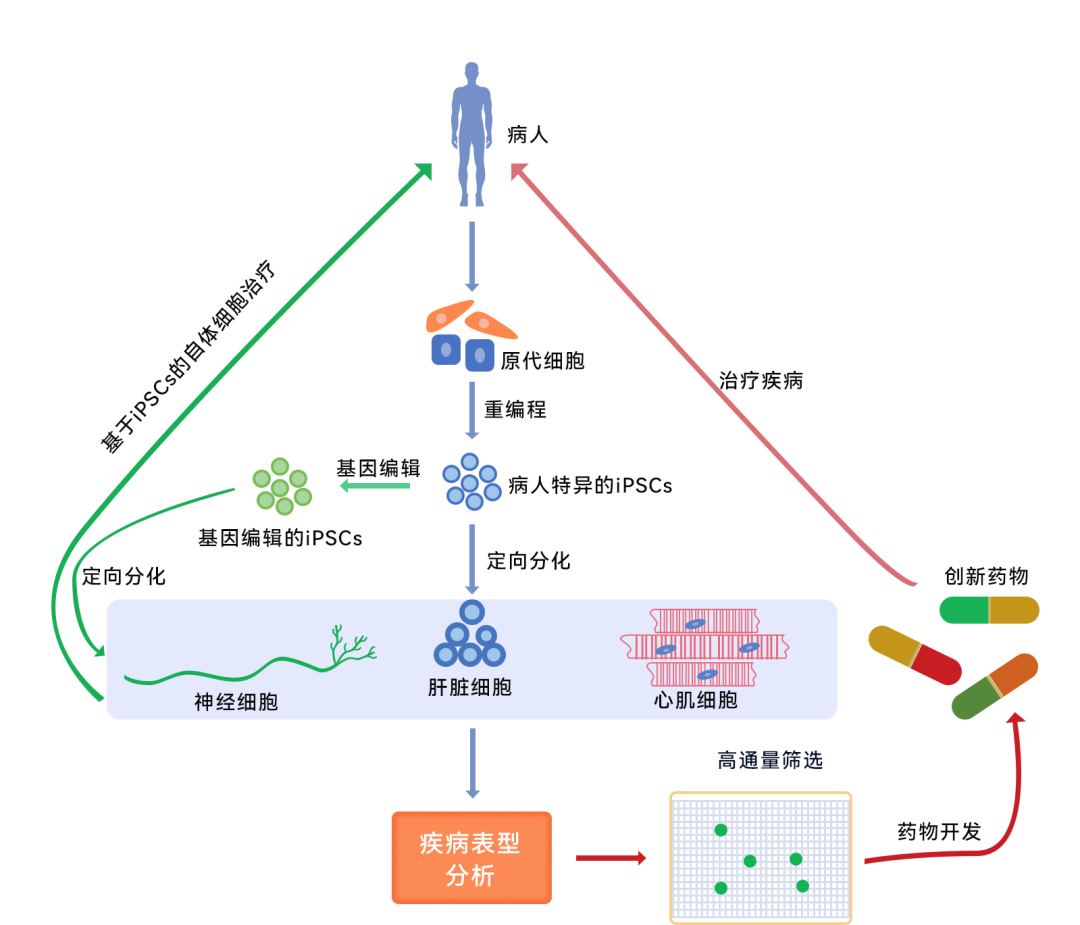
此外,研究人员已成功诱导出疾病特异性的OGC-iPSC,这有助于多囊卵巢综合征、卵巢早衰(POF)、及其他具有潜在遗传因素导致的不孕症的机制研究和药物筛选。
干细胞是现在整个生命科学的前沿,也是未来应用中大家最关注的一个焦点。在我国,干细胞按药品、技术管理的“类双轨制”监管政策下,我国干细胞研究的临床转化已取得重要进展。 而iPSC的出现,让再生医学界摆脱了胚胎干细胞研究相关的伦理桎梏,在短短的十年内就从实验室走向了临床应用,造福于人类。根据2020年iPSC全球市场报告显示,2018年全球iPSC市场价值约为19.8亿美元,预计2022年将以9.2%的复合年增长率增长至28.2亿美元。
在全球范围内,各国对iPSC研究的资助一直在加速。例如,美国国立卫生研究院(NIH)每年在干细胞研究项目上投资15亿美元;加州再生医学研究所(CIRM)批准了一项计划,斥资30亿美元支持干细胞研究;此外,日本教育部还宣布计划在10年内投入1100亿日元(11.3亿美元)用于iPSC的研究。
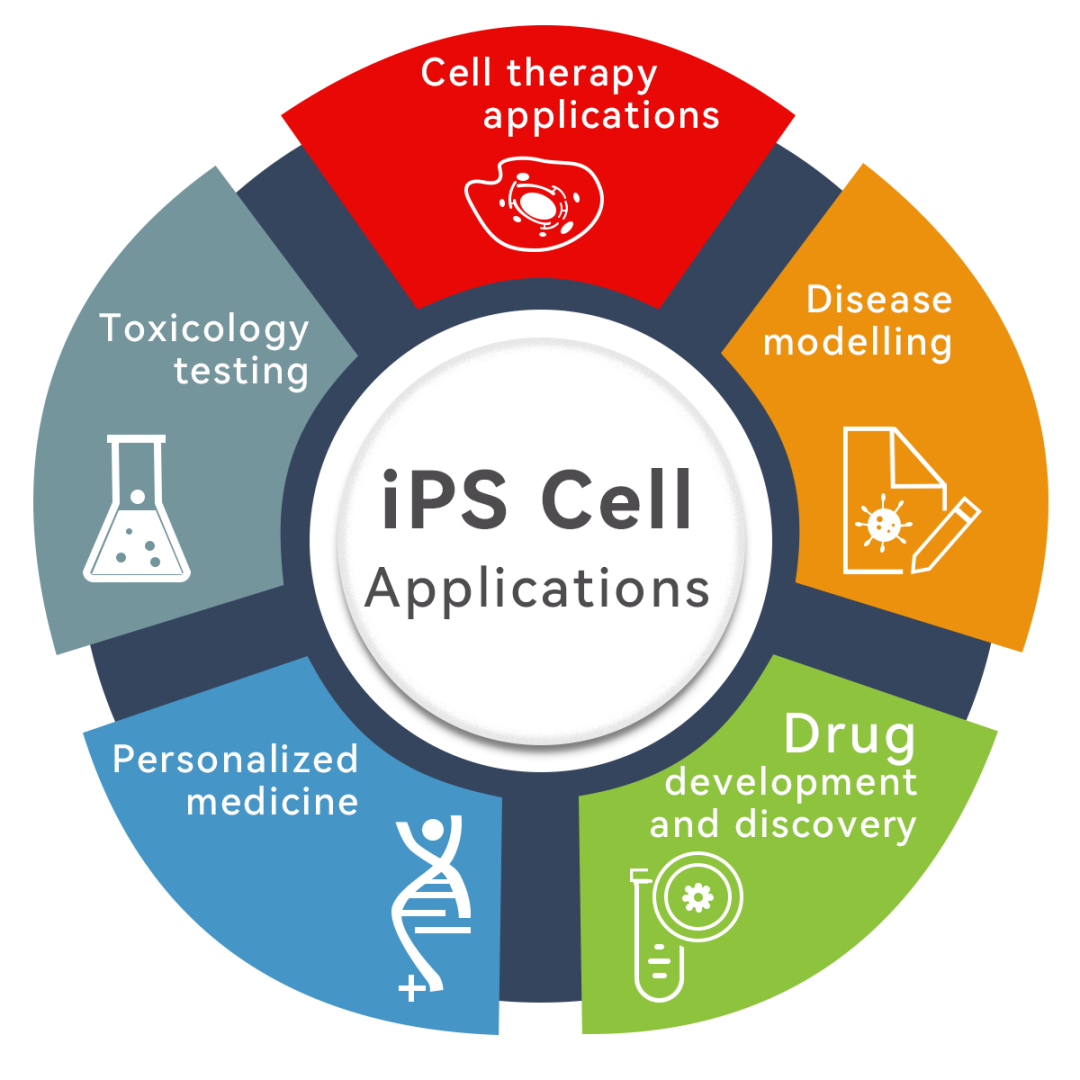
如今,iPSC的商业布局主要包括:药物研发(为药物的发现、鉴定和筛选、靶标验证等提供生理相关细胞);毒理学筛查(用于评估活细胞内化合物或药物的安全性);个性化医疗(与CRISPR等基因编辑技术的结合);细胞疗法(iPSC来源的CAR-T、NK、间充质干细胞疗法等);疾病模型。我们期待针对iPSC的法规也能逐步完善,促使iPSC进一步释放其潜能,持续为再生医学及其他领域带来更多可能!